27/05/2015
Peptídeos antimicrobianos como uma alternativa para o controle de fitopatógenos
Por: Maria do Carmo de Freire Bastos
Extensas perdas econômicas associadas à agricultura são derivadas de doenças causadas por microrganismos em plantas de importância agronômica. Essas doenças têm como importantes agentes bactérias e fungos fitopatogênicos.
As medidas de controle dessas infecções geralmente envolvem o uso extensivo de pesticidas. Entretanto, tal estratégia apresenta diversas desvantagens, entre as quais vale a pena destacar os custos desse tratamento para o agricultor, a seleção de microrganismos resistentes aos pesticidas empregados e os riscos ambientais oriundos do acúmulo dessas substâncias no solo. Por isso, outra forma de se evitar tais infecções envolve a obtenção de plantas carreando genes naturais de resistência aos fitopatógenos. Entretanto, dependendo da planta, esta estratégia possui uso limitado devido à escassez desses genes de resistência naturais e ao longo período necessário para o cruzamento de plantas relacionadas, isto é, sexualmente compatíveis. Assim sendo, outra possibilidade hodierna que se tem mostrado bastante promissora é a obtenção de plantas carreando genes codificadores de peptídeos antimicrobianos de amplo espectro de ação (PAMs).
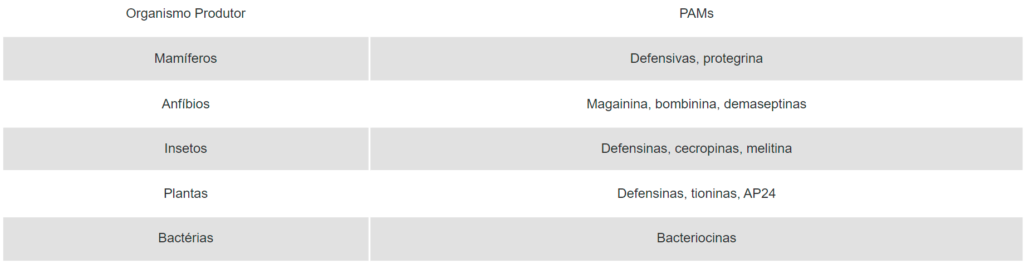
Os PAMs são produzidos por uma variedade de organismos procarióticos e eucarióticos, incluindo-se microrganismos, plantas, animais invertebrados e vertebrados (Quadro 1). Eles são considerados parte integrante da imunidade inata e a primeira linha de defesa das células contra microrganismos invasores (Jenssen et al., 2006). A maioria desses PAMs é catiônica e hidrofóbica a age ao nível da membrana citoplasmática das células-alvo, levando-as à morte. Entretanto, alguns desses PAMs possuem outros sítios-alvo de ação, como a parede celular, hidrolisando-a.
PAMs de diversas origens têm sido utilizados para a obtenção de plantas transgênicas. As plantas transgênicas são definidas como aquelas plantas carreando novos genes, oriundos de outras plantas, relacionadas ou não, de microrganismos ou de animais. A introdução desses genes nessas plantas é realizada por meio de experimentos de transformação, que, neste caso, representa a implantação de novos genes por mecanismos moleculares que não envolvem cruzamento e fecundação.
Quadro 1. Alguns exemplos de PAMs produzidos por organismos eucarióticos e procarióticos.
As etapas para o desenvolvimento de uma planta transgênica incluem:
1. Seleção do gene de interesse;
2. Clonagem do gene em um vetor de expressão em eucarioto;
3. Transformação da planta escolhida com o vetor recombinante;
4. Integração do gene de interesse ao genoma da planta;
5. Seleção das plantas transformadas;
6. Expressão do gene de interesse e
7. Transmissão do gene aos descendentes.
Como exemplo, iremos abordar a obtenção de plantas transgênicas simples, duplas ou triplas de um cultivar de batata (Solanum tuberosum cv. Spunta), carreando os genes estruturais dos PAMs dermaseptina, lisozima e AP24, descrita no trabalho publicado por Rivero e colaboradores (2012). As características dos três PAMs estão sumarizadas no Quadro 2. Para a obtenção das plantas transgênicas, foi empregada a técnica de transformação baseada na utilização dos plasmídeos Ti (Kado, 1993).
Quadro 2. Características dos PAMs empregados para a obtenção de plantas transgênicas de Solanum tuberosum cv. Spunta.

aa, ácidos aminados
Plasmídeos Ti
Os plasmídeos Ti (de indução de tumor) são megaplasmídeos de cerca de 200 kb encontrados em algumas estirpes de Agrobacterium tumefaciens, uma bactéria Gram-negativa encontrada no solo (Kado, 1993; Schröder & Lanka, 2005). Em sua organização genética, os plasmídeos Ti possuem duas regiões muito importantes para a formação de tumores nas plantas (Figura 1):
1. Região do DNA T. Esta região tem cerca de 25 kb e é ladeada por repetições diretas de 25 pb, chamadas bordos direito e esquerdo, e contém genes estruturais codificadores de auxinas e citocininas (ambas representando hormônios de crescimento vegetal) e de opinas (que são ácidos aminados condensados a açúcares), entre as quais predominam a octopina ou a nopalina. É esta região do DNA T que o A. tumefaciens é capaz de transferir para as plantas, gerando a formação de tumores.
2. Região vir. Esta região tem cerca de 35 kb e 25 genes vir (de virulência), agrupados em seis ou sete operons. Estes genes codificam todas as proteínas necessárias à formação de um canal intermembrana, entre a bactéria e a célula vegetal, e à transferência do DNA T para esta célula.

Figura 1. Esquema simplificado dos plasmídeos Ti, mostrando a região vir e a região do DNA T. Os triângulos azuis representam os bordos direito e esquerdo, os retângulos vermelho, amarelo e verde representam, respectivamente, os genes estruturais das auxinas, citocininas e opinas, e o retângulo verde riscado representa os genes envolvidos no catabolismo das opinas. Os vários plasmídeos Ti diferenciam-se, entre outros aspectos, pelo tipo de opina codificado e pelos genes responsáveis pelo seu catabolismo.
Quando o DNA T é transferido para a planta (somente uma das fitas do DNA é transferida), após contato celular estabelecido entre a bactéria e a célula vegetal (Figura 2), este DNA é transportado para o núcleo da célula, onde o DNA T se integra a um dos cromossomos, de uma forma randômica. Como os genes das auxinas, das citocininas e das opinas possuem promotores eucarióticos, após a integração, eles podem se expressar. A síntese das auxinas e das citocininas leva a uma multiplicação descontrolada das células vegetais, resultando na formação de tumores nas plantas. Já as opinas produzidas serão excretadas pelas células tumorais e servirão de fonte de C e de N para a nutrição bacteriana.

Figura 2. Esquema simplificado da transferência de uma fita do DNA T do plasmídeo Ti para a planta. A fita do DNA T é liberada do plasmídeo mediante a ação principal de duas proteínas Vir (VirD1 e VirD2), sendo que VirD2 () permanece covalentemente ligada ao extremo 5’ P da fita T liberada). Em seguida, a fita T é transferida para a célula vegetal mediante a formação de um canal intermembrana, ligando as duas células, formado por várias proteínas Vir (compondo um sistema de secreção do tipo 4). Uma vez no citoplasma da célula vegetal, a fita T é transferida para o núcleo, mediante a participação de proteínas Vir e de proteínas vegetais envolvidas em localização nuclear, e depois se integra a um cromossomo, passando a expressar os genes nela contidos.
Obtenção das plantas transgênicas contendo os genes estruturais de PAMs
Inicialmente, os genes codificadores da dermaseptina (De), da lisozima (Ly) e do AP24 (Ap) foram, separadamente, clonados em vetores de expressão apropriados. A clonagem foi feita dentro da região do DNA T, sendo que os genes dos hormônios de crescimento e da opina foram substituídos pelo gene de interesse, como mostrado na Figura 3. Os plasmídeos recombinantes gerados (pDe, pLy, pAp e pApLy) foram introduzidos no cultivar de batata escolhido (Spunta) por meio de transformação binária (Murai, 2013).

Figura 3. Características das sequências de DNA clonadas, carreando os genes estruturais codificadores de PAMs.
Na transformação binária, a planta é infectada por uma estirpe de A. tumefaciens carreando dois plasmídeos: um plasmídeo Ti, com deleção (D) de toda a região do DNA T, mas portador da região vir, e o plasmídeo recombinante contendo o gene de interesse e um gene marcador clonados na região do DNA T modificada, que só conserva os bordos direito e esquerdo. Os genes vir localizados no plasmídeo DTi irão promover a liberação da fita T, localizada no plasmídeo recombinante, e a sua transferência para as células vegetais. No caso da batata, foram empregados discos de minitubérculos para a infecção. Assim sendo, quando em contato com esses discos, a estirpe de A. tumefaciens pôde transferir o gene de interesse e o gene marcador para as células vegetais, mas não pôde mais causar a formação de tumores. Após a infecção, os minitubérculos foram, então, transferidos para um meio de cultivo adequado contendo o agente seletivo apropriado (glifosinato, higromicina ou canamicina). Após cerca de três semanas, foram obtidas plântulas resistentes aos agentes seletivos, que foram, então, crescidas em frascos com meio de cultura e, depois, transferidas para vasos com solo estéril, gerando as “explantas” (plantas derivadas de transformação).
A confirmação da presença dos genes de interesse nas “explantas” foi feita por PCR, empregando-se DNA extraído das folhas. A planta transgênica contendo o gene De foi, posteriormente, retransformada com o plasmídeo recombinante pApLy, gerando uma planta transgênica tripla, DeApLy, resistente ao glifosinato e à canamicina.
Os cinco tipos de plantas transgênicas (De, Ly, Ap, ApLy e DeApLy) foram testados quanto à resistência a cinco fitopatógenos de batateiras: duas espécies de bactérias (Erwinia caratovora eStreptomyces scabies) e três espécies de fungos (Phytophthora infestans, Rhizoctonia solani e Fusarium solani), empregando-se diferentes modelos de infecção: broto axial, folhas ou tubérculos. Os resultados obtidos estão sumarizados no Quadro 3.
++++, resistência >80%; +++, resistência entre 61 e 80%; ++, resistência entre 41 e 60%; +, resistência entre 21 e 40%; ±, resistência entre 5 e 20%; -, resistência <5%. Este nível de resistência foi determinado em função do número de plantas ou tubérculos testados (geralmente, em torno de 60 plantas ou tubérculos por tipo, oriundos de três experimentos independentes) que apresentaram sintomas e da gravidade dos sintomas observados: necrose, crestamento, clorose ou podridão.
Baseando-se nos experimentos realizados, pôde-se concluir:
● que as plantas transgênicas De, Ly, ApLy e DeApLy exibiram um alto nível de resistência aos patógenos bacterianos;
● que o nível de resistência aos fungos variou dependendo do gene presente na planta transgênica ou da combinação desses genes;
● que as plantas transgênicas duplas ou triplas foram as que exibiram um maior nível de resistência aos cinco patógenos testados, que são muito frequentes nas áreas de cultivo de batatas.
Os resultados aqui resumidos indicam que PAMs podem funcionar como uma nova fonte de resistência das plantas a um amplo grupo de fitopatógenos, podendo ser utilizados na prevenção de doenças de impacto econômico. Entretanto, embora os resultados apresentados neste trabalho sejam bastante promissores, demonstrando, de forma inequívoca, o potencial biotecnológico de PAMs também na agricultura, a efetividade dessas substâncias produzidas plantas transgênicas precisa ainda ser comprovada em experimentos de campo, em diferentes ecossistemas agrários, onde ocorre a interferência de fatores abióticos e bióticos, não levados em consideração nos experimentos realizados em condições ambientais controladas e em solo ou meio de cultivo estéril.
Referências:
Jenssen, H., Hamill, P. & and Hancock, R.E.W. 2006. Peptide antimicrobial agents. Clin. Microbiol. Rev., 19: 491-511.
Kado, C.I. 1993. Agrobacterium-mediated transfer and stable incorporation of foreign genes in plants. In: Bacterial Conjugation. Edited by D.B. Clewell, Plenum Press, New York, pp. 243-254.
Murai, N. 2013. Plant binary vectors of Ti plasmid in Agrobacterium tumefaciens with a broad host-range replicon of pRK2, pRi, pSa or pVS1. Am. J. Plant Sci., 4: 932-939.
Rivero, M., Furman, N., Mencacci, N., Picca, P., Toum, L., Lentz, E., Bravo-Almonacid, F. & Mentaberry, A. 2012. Stacking of antimicrobial genes in potato transgenic plants confers increased resistance to bacterial and fungal pathogens. J. Biotechnol., 157: 334-343.
Schröder, G. & Lanka, E. 2005. The mating pair formation system of conjugative plasmids – A versatile secretion machinery for transfer of proteins and DNA. Plasmid, 54: 1-25.


